1. 서 론
2. 연구방법
2.1 어류 폐사의 주요 물리적 요인 및 어종 분석
2.2 노출 실험 어종 선정
2.3 실험어종 입수 및 순화
2.4 실험 조건 및 구성
2.5 RNA 샘플 전처리 및 분석
2.6 통계분석
3. 결과 및 고찰
3.1 용존산소(DO) 고갈
3.2 수온 변화
3.3 pH 변화
3.4 고탁도
3.5 RNA sequencing을 통한 유전자 발현 분석
4. 결 론
1. 서 론
어류 폐사는 수온 변화(Durham et al., 2006; Amir et al., 2022), 용존산소 부족(Matthews & Berg, 1997; Lee et al., 2013), 자연사, 산란기 등과 같은 자연적 영향, 이·치수를 위한 수위 변동, 오염물질 또는 독성물질 유입(Van Hoof & Van San, 1981) 등 인위적 영향, 세균·기생충 감염, 염분 변화, 강우 등과 같은 환경 스트레스 영향 등 다양한 원인이 복합적으로 작용하여 발생하기 때문에 정확한 원인 규명에 어려움이 따른다(Haslouer, 1983; Lee et al., 2006).
한국환경공단(2023)의 ‘2022년도 수질오염사고와 대응 연차보고서’에 따르면, 2018~2022년 전국에서 발생한 어류 폐사는 총 172건으로, 매년 약 43건 발생하였다. 주요 원인으로는 수온 변화, 용존산소 감소, 오염물질 유입 등과 같은 수환경 변화(81건, 47.1%)가 가장 높은 비율을 차지하였으며, 원인을 확인할 수 없는 원인불명의 비율은 45건(26.2%)으로 조사되었다. 이처럼 원인불명의 비율이 높은 이유는 어류 폐사 발생 시, 폐사체를 발견하기까지 상당한 시간이 소요되고, 시간이 경과함에 따라 사체가 부패하여 사인 파악이 어려우며(국립환경과학원, 2014), 자연 회복, 희석 등으로 어류 폐사 당시의 환경 조건 및 오염원 등 어류 폐사의 원인을 밝혀낼 증거들이 빠르게 사라져 원인 규명을 할 수 없기 때문이다. 따라서 어류 폐사의 원인 규명을 위해서는 신속 정확한 초동대응을 통한 현장 대응 및 증거 수집이 매우 중요하다.
현재 우리나라의 어류 폐사 대응 매뉴얼의 경우, 환경부에서 발간한 「대규모 수질오염」 위기대응 실무매뉴얼(환경부, 2016)’을 근간으로 각 지자체 및 기관에서는 자체 여건에 맞는 대응 매뉴얼을 작성하고 이에 따라 대응하고 있다. 하지만 이러한 어류 폐사 대응 매뉴얼에 따라 현장에서 업무를 수행하기에는 어류 및 생태학에 대한 전문지식이 요구되며, 생소한 용어와 개념이 많아 비전문가로 구성되어 있는 실무자들이 이행하기에는 어려움이 따른다. 또한, 우리나라에서 발생한 어류 폐사의 약 80%는 하천에서 발생(국립환경과학원, 2018)하고 있으며, 대응 매뉴얼 또한 하천 중심으로 작성되어 있어 댐호에서 발생하는 어류 폐사 대응에는 다소 차이가 있는 실정이다.
댐/저수지는 하천과 달리 물의 흐름이 느리고 수심이 깊은 정수역으로서 하천과 비교해 수체의 규모가 크고 안정되어 있어 어류 폐사 발생건수는 연평균 4건(KRM; K-water risk management)으로 하천(약 40건)에 비해 적지만 어류 폐사 발생 시 대규모로 발생할 가능성이 있으므로 어족자원 보호 및 신속한 대응을 위해서는 댐호를 위한 어류 폐사 대응 매뉴얼 작성이 필요하다.
따라서 본 연구에서는 댐호에서 발생하는 어류 폐사 대응 매뉴얼의 기초자료로 활용하기 위해 K-water에서 관리하고 있는 댐/저수지를 대상으로 어류 폐사의 물리적 환경 요인 및 어종을 분석하여 노출 실험을 실시하고, 이때 발생하는 증상 및 유전자 발현 결과를 분석하여 신속한 어류 폐사 대응 및 원인 분석을 위한 자료를 제공하고자 한다.
2. 연구방법
2.1 어류 폐사의 주요 물리적 요인 및 어종 분석
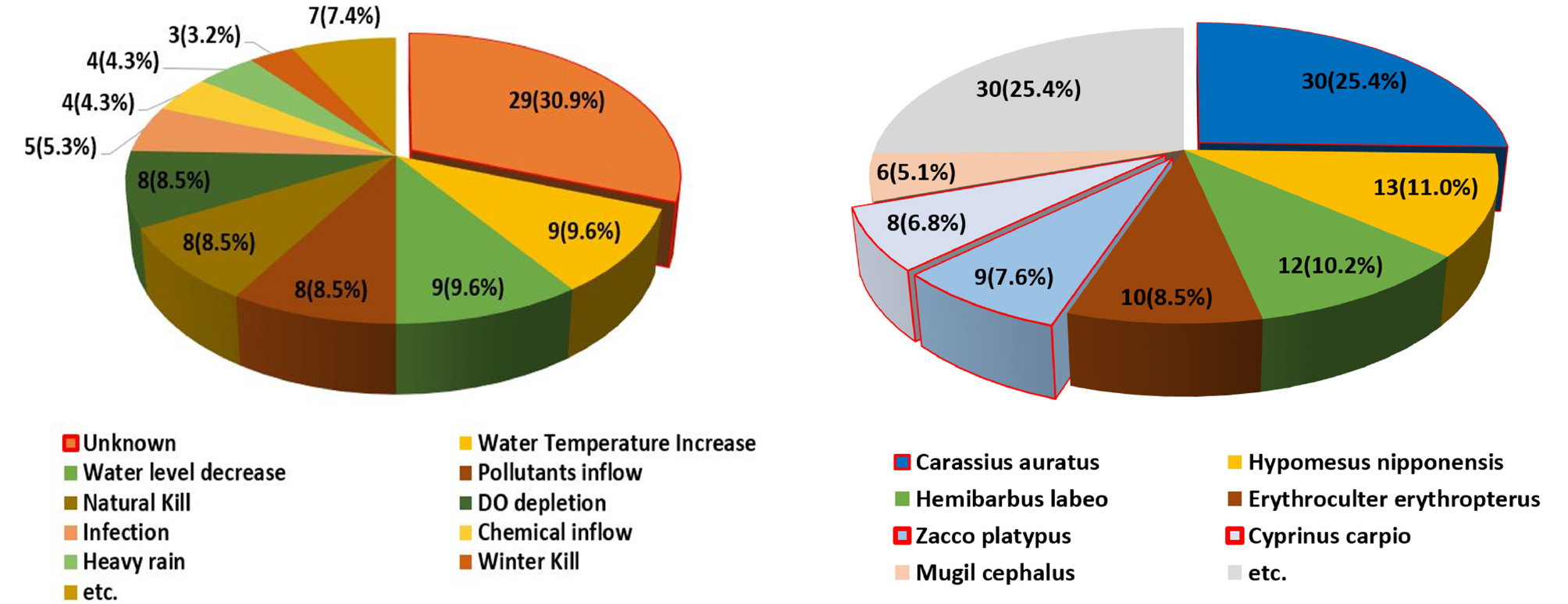
1999~2023년 KRM 및 언론 보도를 통한 어류 폐사 자료를 분석하여 K-water에서 관리하는 댐호 내 주요폐사 어종과 폐사 요인을 분석하였다(Fig. 1). 분석 결과, 수온 상승(9건, 9.6%), 수위 감소(9건, 9.6%), 용존산소 부족(8건, 8.51%) 등이 주요 물리적 요인이었으며, 주요폐사 어종은 붕어(Carassius auratus), 빙어(Hypomesus nipponensis), 누치(Hemibarbus labeo), 강준치(Chanodichthys erythropterus), 피라미(Zacco platypus), 잉어(Cryprinus carpio) 순으로 확인되었다.
2.2 노출 실험 어종 선정
물리적 환경 요인에 대한 어류 노출 실험종 선정 조건은 첫째, 댐호에서 발생한 어류 폐사 사례에서 가장 빈번하게 출현하는 종, 둘째, 서식 범위가 넓어 전국 댐호에서 널리 서식하는 종, 셋째, 실험종으로서 확보가 쉬우며, 사육 및 실험이 용이한 종, 넷째 노출 실험에 많이 활용되어 자료가 풍부한 종으로 하였다. 댐호에서 발생한 어류 폐사 사례 분석 결과 주요폐사 어종은 붕어(30건, 25.42%), 빙어(13건, 11.0%), 누치(12건 10.2%), 강준치(10건, 8.5%), 피라미(9건, 7.63%), 잉어(8건, 6.78%)로 확인되었고, 이 중 상기 선정 조건에 따라서 붕어, 피라미, 잉어를 선정하였다(Fig. 1). 붕어, 피라미, 잉어는 댐호뿐만 아니라 전국 하천에서 광범위하게 서식하는 종으로서 노출 실험에 빈번하게 사용되며, 노출 실험을 위한 종 수급이 용이한 장점이 있다.
또한 물리적 환경 요인에 따른 RNA 발현 특성 분석을 위해 국제 실험종인 제브라피쉬(Danio rerio)를 실험종으로 추가 선정하였다. 제브라피쉬는 유전자 지도가 작성된 종으로서 독성실험에 많이 사용되어 실험자료가 풍부하며, 실험 개체를 쉽게 확보할 수 있어 세계적으로 널리 사용되는 종이다.
2.3 실험어종 입수 및 순화
실험 어종은 보령민물생태관을 통해 야생에 서식하는 개체를 채집하여 실험에 사용하였다. 실험에 사용한 개체의 전장 및 체중은 붕어가 전장 17.7±1.4cm, 체중 79.1±23.9g이었고, 잉어는 전장 15.4±1.6cm, 체중 52.6±12.5g이었고, 피라미는 전장 9.5±2.5cm, 체중 7.0±5.1g이었다. 제브라피쉬는 충남대학교 생물과학과 발생유전학 실험실에서 사육하고 있는 Wild-type의 개체를 분양받아 실험에 사용하였고, 전장과 체중은 각각 3.1±0.2cm, 0.2±0.1g이었다.
각각의 실험종은 분양 후 실험실에서 최소 2주 이상의 순화 기간을 거친 후 외형적 이상이 없는 건강한 개체를 선별하여 실험에 사용하였다. 순화 기간 동안 사용된 사육수는 24시간 이상 폭기한 탈염소수를 사용하였으며, 수온은 22.5±0.5℃, 용존산소량(DO)은 9.0.±0.5, mg/L, pH 7.5~8.0의 환경 조건에서 순화하였다. 순화에 사용된 수조는 화학물질에 대해 불활성 재질의 20L(Φ360×240mm) 및 100L(900×300×400mm) 용량의 유리 수조를 사용하였다. 각 수조에 투입한 개체수는 1g fish weight/1L water의 조건에 맞도록 개체 밀도를 조절하였다.
2.4 실험 조건 및 구성
어류 폐사의 노출 실험을 위한 주요 물리적 환경 요인은 첫째, 사고 사례에서 빈번하게 발생하고, 둘째, 실험실에서 구현할 수 있는 조건 등을 고려하여 선정하였다. 댐호에서 발생한 어류 폐사 사례 분석을 통한 주요 원인은 원인불명이 30.9%로 가장 높은 비율을 차지하였고, 수온 상승(9건, 9.6%), 수위 감소(9건, 9.6%), 오염물질 유입(8건, 8.5%), 자연사망(8건, 8.51%), 용존산소 부족(8건, 8.51%) 등으로 확인되었다(Fig. 1). 이 중 상기 조건에 따라 수온 변화, 화학물질 유입에 따른 pH 변화, 용존산소(DO; Dissolved oxygen) 고갈, 탁수 유입 등 물리적 환경 요인을 선정하였으며, 노출 실험 조건은 Table 1과 같다.
Table 1.
Summary of the experimental design of physical condition factors of fish-kill
용존산소 고갈 노출 실험(LDO; Low dissolved oxygen)의 경우, 노출 수조에 질소(N2) 가스를 폭기하여 DO를 2.0mg/L 이하까지 서서히 낮추며, 어류 반응 및 증상을 관찰하였다. 고수온 실험은 온도가 서서히 오를 경우와 갑자기 오를 경우를 고려하여 실시하였다. 고수온 저속 노출 실험(HTS; High temperature slowly)의 경우, 히터를 이용하여 수온을 상온(22℃)에서 32℃ 이상의 온도로 서서히 상승시키며, 어류 반응 및 증상을 관찰하였으며, 고수온 급속 노출 실험(HTQ; High temperature quickly)의 경우, 상온(22℃)에서 순화한 어류를 미리 준비한 32℃ 이상의 고온 수조에 바로 노출하여 어류 반응 및 증상을 관찰하였다. 저수온 실험 역시 온도가 서서히 감소하는 경우와 갑자기 감소하는 경우를 고려하여 실시하였다. 저수온 저속 노출 실험(LTS; Low temperature slowly)의 경우, 드라이아이스를 이용하여 수온을 상온(22℃)에서 10℃ 이하의 저온으로 감소시키며, 어류 반응 및 증상을 관찰하였으며, 저수온 고속 노출 실험(LTQ; Low temperature quickly)의 경우, 상온(22℃)에서 순화한 어류를 드라이아이스를 이용하여 10℃ 이하로 낮춘 저온 수조에 즉시 노출한 후 어류의 반응 및 증상을 관찰하였다. 산성 노출 실험(pHL; pH Low)의 경우, HCl 희석액을 이용하여 pH를 2.0 이하로 조성한 후 어류를 노출하여 어류 반응 및 증상을 관찰하였으며, 염기성 노출 실험(pHH; pH High)의 경우 pH 10 및 pH 12 조건에서 실시하였고, NaOH 수용액을 이용하여 pH를 각각 10.0, 12.0 이상으로 조성한 후 어류를 노출하여 어류 반응 및 증상을 관찰하였다. 고탁도 노출 실험(HTu; High Turbidity)의 경우, 점토와 수류기를 이용하여 탁도를 1,000 NTU 이상으로 조성한 후 어류를 노출하여 어류 반응 및 증상을 관찰하였다.
노출 실험의 환경 조건 및 기본 사항은 국립환경과학원 고시 화학물질의 시험방법에 관한 규정(국립환경과학원, 2024)을 준용하여 실시하였다. 실험에 투입한 개체는 실험동물 윤리 규정을 준수하기 위해 최소 마릿수로 설정하여 붕어, 잉어, 피라미의 경우 노출 실험별 3마리씩, 제브라피쉬는 RNA 분석 sample 확보를 위해 노출실험 별 5마리씩 설정하였다.
노출실험에 사용한 수조는 1g fish weight/1L water의 조건을 만족하기 위해 붕어, 잉어, 피라미의 경우 100L 크기의 수조에서 실험을 진행하였으며, 제브라피쉬는 20L 크기의 원형 수조에서 실험을 진행하였다. 노출 시간은 어류 폐사 증상 관찰의 목적에 맞도록 어류의 사망 시 종료하였다.
주요 관찰 항목은 노출 조건 별 어류의 반응 특성 분석을 위해 영상을 촬영하여 노출 후 사망 시간, 증상, 수질(다항목 수질측정기; YSI ProDSS) 등을 관찰하였고, 사망 개체는 즉시 해부하여 내장 기관 영향 특성을 관찰하였다.
2.5 RNA 샘플 전처리 및 분석
RNA 분석은 유전자 분석 자료가 풍부하여 RNA 발현 특성을 비교·분석할 수 있는 제브라피쉬를 대상으로 실시하였다. 노출 후 사망 개체 발생 시 즉시 해부를 통한 외형 및 내장 기관의 증상을 관찰한 후 균질기에 어류 사체 및 RNA 분리 시약(TRIzol; Thermo fisher) 1mL/1g fish weight를 넣어 고르게 균질화하여 냉동 보관하였다. RNA 분석은 M사에 의뢰하여 전사체 서열분석(Transcriptome sequencing)을 실시한 후 유전자 발현 특성을 분석하였다.
2.6 통계분석
RNA 분석을 통해 확보된 유전자 발현 값은 대조군과의 차이를 확인하고 GO(Gene ontology) 및 DEG (Differentially expressed genes) 분석을 통해 노출 조건에 따른 유전자 발현 특성을 분석하였다. 샘플 간 상관성 분석(Pearson’s coefficient)을 통해 상관관계 확인 및 계층군집 분석(Hierarchical clustering), 다차원 척도 분석(MSD; Multidimensional scaling)을 실시하여 대조군과 비교해 활성화된 유전자의 차이를 분석하였다.
3. 결과 및 고찰
3.1 용존산소(DO) 고갈
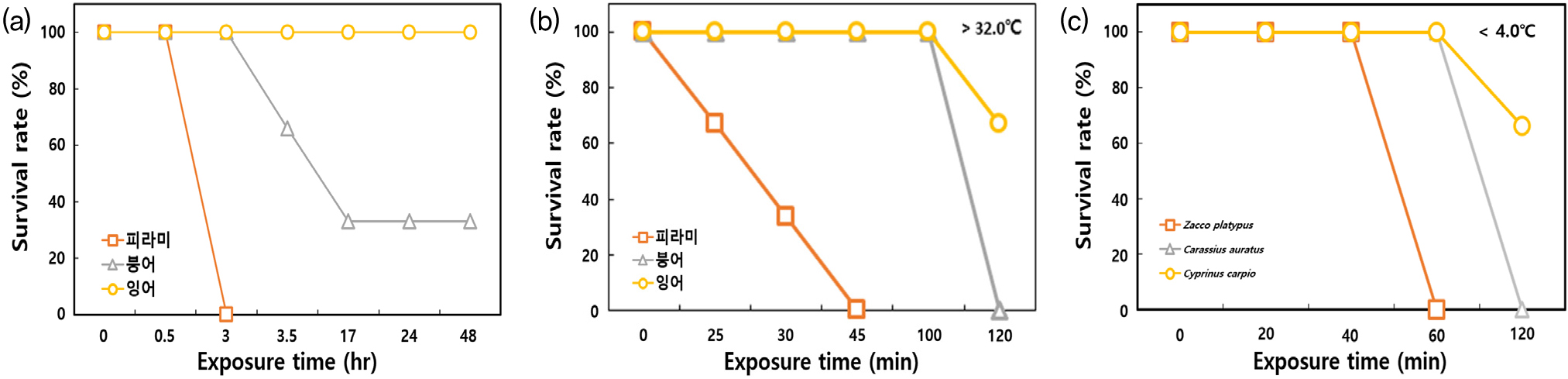
용존산소 고갈의 실험 결과, 피라미, 붕어, 잉어 등 모든 종에서 과호흡, 수표면 유영, 입올림과 아가미덮개 개방, 유영능력 감소, 균형감각 상실 등 동일한 증상이 일관되게 관찰되었다. 또한 같은 종 내에서 증상이 발생하는 시간의 차이는 있었으나 크기가 큰 개체들부터 증상이 나타났다. 시간에 따른 증상 발생 순서는 DO가 감소함에 따라 과호흡이 관찰되기 시작하였고 수면으로 떠 올라 공기 중의 산소를 입으로 마시면서 기포를 발생시켜 필요한 산소를 확보하려는 행동을 보였다. 그 후 유영능력이 감소하고 균형감각을 상실하여 사망에 이르는 것으로 관찰되었으며, 사망한 개체에서는 대부분 입올림 증상이 관찰되었다. DO에 대한 민감도는 피라미>붕어>잉어 순으로 나타났다(Fig. 2(a)).
DO 농도에 따른 증상 관찰 결과, 노출 시작 시 평균 8.9mg/L(100.8%)에서 노출 후 30분 경과 시 약 4.0mg/L까지 감소함에 따라 피라미, 붕어, 잉어 순서로 과호흡 증상 및 수표면 유영 증상이 나타나기 시작하였다. 노출 후 3시간 경과 시 DO 농도가 1.13mg/L(13.0%) 수준으로 감소하면서 피라미에서 균형감각 상실 및 치사 개체가 관찰되었고, 10분 이내에 100% 사망하였다. 붕어는 노출 후 약 3시간 30분 0.74mg/L(8.5%) 농도에서 최초 사망 개체가 관찰되었고, 나머지 개체에서 수표면 유영, 균형감각 상실 등의 증상이 관찰되었다. 노출 후 17시간 경과 시 0.68mg/L(7.2%) 농도에서 두 번째 사망 개체(사망률: 66%)가 관찰되었으며, 나머지 한 마리는 실험 종료 시점(48시간)까지 균형감각 상실 증상을 보이며 생존하였다. 동일한 농도 및 시간에서 잉어의 경우 과호흡, 수표면 유영 등의 증상을 보였으며, 실험 종료 시점까지 모든 개체가 생존하여 용존 산소에 대한 내성이 가장 강한 것으로 확인되었다(Fig. 2(a)).
해부를 통한 외형 및 내장 기관 관찰 결과, 물리적 손상 및 형태 이상 증상은 관찰되지 않았다. 이는 DO 농도만을 통제하여 실시한 실험 조건의 결과로서 자연환경 조건에서 발생하는 어류 폐사는 DO 감소와 더불어 다양한 환경 스트레스가 동반되는 점을 고려하였을 때 자연계에서 사망을 유발하는 DO 농도는 본 실험 결과보다 더 높아질 수 있으며, 외형적 손상을 동반할 가능성이 있을 것으로 판단된다.
수체 내 용존 산소 농도에 영향을 미치는 요인은 집중강우, 녹조현상, 기후변화 등(국립환경과학원, 2014)이 대표적으로 알려져 있다. 어류가 정상적으로 활동할 수 있는 DO 농도는 최소 4.0mg/L 이상이며, 4.0mg/L 이하로 감소할 경우 어류 체내에 이상 증상이 발생하기 시작한다. 일반적으로 DO가 낮아지면 어류는 다른 공간으로 회피하게 되지만 넓은 지역에서 광범위하게 발생하거나 고립되어 있는 경우에는 직접적인 영향을 받게 된다. 어류가 낮은 DO 환경에 노출되면, 과호흡, 유영능력 감소, 수표면 유영 등의 증상을 보이며, 먹이활동 및 에너지 전환율에 영향을 미치게 된다(Oldham et al., 2019). 또한 이러한 환경에 지속적으로 노출되었을 경우, 적혈구 수 증가(Kim, 2021), 스트레스 효소 및 호르몬 증가(Barton & Schreck, 1987) 등 체내 방어기제가 작동하게 되어 에너지 사용량이 증가하게 되고 성장 지연 등의 악영향을 미치며, 폐사로 이어질 수 있고(Herrmann et al., 1962; Hutchins, 1973; Keister & Breitburg, 2000; Kim et al., 2015), 용존산소 감소로 인해 황화수소(H2S)나 암모니아(NH3)와 같은 다양한 이온들이 독성을 띠게 되어 2차 피해를 유발할 수도 있다(Merkens & Downing, 1957; Randall & Tsui, 2002; Delbol’skaya et al., 2005; Riesch & Plath, 2014). 본 연구의 LDO 실험에서는 과호흡, 수표면 유영 등 증상을 보였고, RNA 분석 결과 체내 화학적 결합과 관련된 유전자의 활성이 확인되어 다양한 단백질 생성 및 반응이 나타나고 있다고 판단되었다.
3.2 수온 변화
수온 상승에 따른 어류의 영향을 확인하기 위해 수조용 히터를 이용하여 수온을 22℃에서 32℃까지 서서히 증가시키며, 노출한 실험 결과, 모든 종에서 사망 개체는 관찰되지 않았다. 노출 수조의 수온은 실험 시작 시 22℃였고, 노출 후 70분 경과 시 30℃까지 상승하였으며, 약 100분 경과 후에 32℃까지 상승하였다. 노출된 어류들은 수온이 오를수록 활동성이 증가하였고, 29℃ 이상부터 호흡 횟수가 증가하는 과호흡 증상이 관찰되기 시작하였으며, 30℃를 넘어서부터 활동성이 현격히 감소하는 무기력 증상이 관찰되었다. 한편 22℃에서 순화 중인 개체를 32℃ 고수온 수조에 즉시 노출한 급격한 수온 변화 조건에서는 노출 직후 발작(1초 이내) 및 경련 증상이 관찰되었고, 수표면에 유영하며, 과호흡 증상으로 이어졌다. 그 후 무기력 증상 및 사망 개체가 관찰되었다. 고수온에 대한 민감도는 피라미>붕어>잉어 순으로 나타났다(Fig. 2(b)). 노출 시간에 따른 증상으로는 피라미의 경우, 노출 직후 발작(1초 이내) 및 경련 증상이 관찰되었고, 20초 경과 후부터 과호흡 및 균형감각 상실이 관찰되었으며, 노출 후 25분부터 45분까지 모든 개체가 사망하였다. 붕어의 경우, 노출 직후 발작(1초 이내) 및 경련 증상이 관찰되었고, 1시간 경과 후부터 과호흡 및 균형감각 상실 증상이 관찰되었으며, 2시간 경과 후 모든 개체가 사망하였다. 잉어의 경우, 노출 직후 발작(1초 이내) 및 경련 증상이 관찰되었고, 1시간 경과 후부터 과호흡 증상 및 균형감각 상실 증상이 관찰되었으며, 2시간 경과 후 최초 사망 개체가 관찰되었다. 이후 나머지 개체는 실험 종료 시점(48시간)까지 균형감각 상실 증상을 보이며, 생존하여 고수온에 대한 내성이 가장 강한 것으로 확인되었다(Fig. 2(b)). 해부를 통한 외형 및 내장 기관 관찰 결과, 물리적 손상 및 형태 이상 증상은 관찰되지 않았다.
낮은 수온으로 인한 어류의 영향을 확인하기 위해 수온을 22℃에서 4℃까지 서서히 감소시키며, 노출한 실험 결과, 호흡 및 활동성 감소, 균형감각 상실, 기절(Cold shock) 등의 증상이 관찰되었으며, 민감도는 피라미>붕어>잉어 순서로 확인되었다(Fig. 2(c)). 노출 수조의 수온은 실험 시작 시 22℃이었고, 노출 후 40분 경과 시 10℃ 이하로 감소하였으며, 약 80분 경과 후에 4℃까지 감소하였다. 수온 감소에 따른 증상 관찰 결과, 피라미의 경우 20분 경과 후 수온이 15℃ 이하에서 호흡 및 활동성이 감소하기 시작하였고, 50분 경과 후 수온이 8℃ 이하에서 균형감각 상실 증상이 관찰되었으며, 60분 경과 후 수온이 4℃ 이하로 감소하였을 때 100% 사망하였다. 붕어의 경우 20분 경과 후 수온이 15℃ 이하에서 호흡 및 활동성이 감소하기 시작하였고, 50분 경과 후 수온이 8℃ 이하에서 균형감각 상실 증상이 관찰되었으며, 2시간 경과 후 4℃ 이하의 수온에서 100% 사망하였다. 잉어의 경우 30분 경과 후 수온이 13℃ 이하에서 호흡 및 활동성이 감소하기 시작하였고, 50분 경과 후 수온이 8℃ 이하에서 균형감각 상실 증상이 관찰되었다. 2시간 경과 후 4℃에서 최초 사망 개체가 관찰되었고 나머지 2개체는 생존하여 저수온에 대한 잉어의 내성이 가장 강한 것으로 확인되었다(Fig. 2(c)). 급격한 수온 변화에 따른 어류의 영향을 확인하기 위해 22℃에서 순화 중인 개체를 4℃ 저수온 수조에 즉시 노출한 결과, 모든 어류에서 노출 직후 발작(1초 이내) 및 경련 증상이 관찰되었고, 1분 경과 후 균형감각 상실 및 기절하여 간헐적으로 호흡이 멈추었으며, 2분을 넘지 않아 100% 사망하였다. 해부를 통한 외형 및 내장 기관 관찰 결과, 물리적 손상 및 형태 이상 증상은 관찰되지 않았다.
수온은 물속에 살고 있는 어류에게 가장 중요한 요소 중 하나로서 각각의 어류는 일정 범위의 수온 내성을 갖고 살아간다(Shamseldin et al., 1997). 그러나 최근 기후변화와 집중강우, 폭염 및 한파 등 기상이변으로 수온의 변화 폭이 증가하였고, 이러한 환경변화로 인해 적정 수온을 벗어날 경우, 어류의 생리적 대사 반응에 직접적으로 영향을 미치며(Shin et al., 2018), 스트레스 증가, 호흡량 및 산소 소비율 변화, 대사작용 저해, 성장 지연 등의 악영향을 미친다(Shin et al., 2018; Amir et al., 2022). 수온이 증가하면 호흡량 및 산소 소비율 증가, 수표면 유영 등의 증상을 보이고, 수온이 감소하면 호흡량 및 산소 소비율 감소, 삼투압 및 이온 조절 장애, 기절(Cold-Shock) 등의 증상을 보인다고 알려져 있다(Stanley & Colby, 1971; Hurst, 2007; Shin et al., 2018). 본 연구에서는 수온이 증가함에 따라 과호흡, 수표면 유영 등의 증상을 보였고, 수온이 감소함에 따라 호흡률과 유영능력이 감소하고 균형감각이 상실하는 등의 증상을 보여 말쥐치를 이용한 선행 연구사례(Kim et al., 2019)와 유사한 결과를 나타내었다. 또한 RNA 분석 결과 체내 세포 내 위치한 유전자, 화학적 결합 관련 유전자, 성장 관련 유전자의 활성이 확인되어 수온 변화가 체내 세포 기작 및 호르몬 생성 등에 영향을 주고 있는 것으로 판단되었다.
3.3 pH 변화
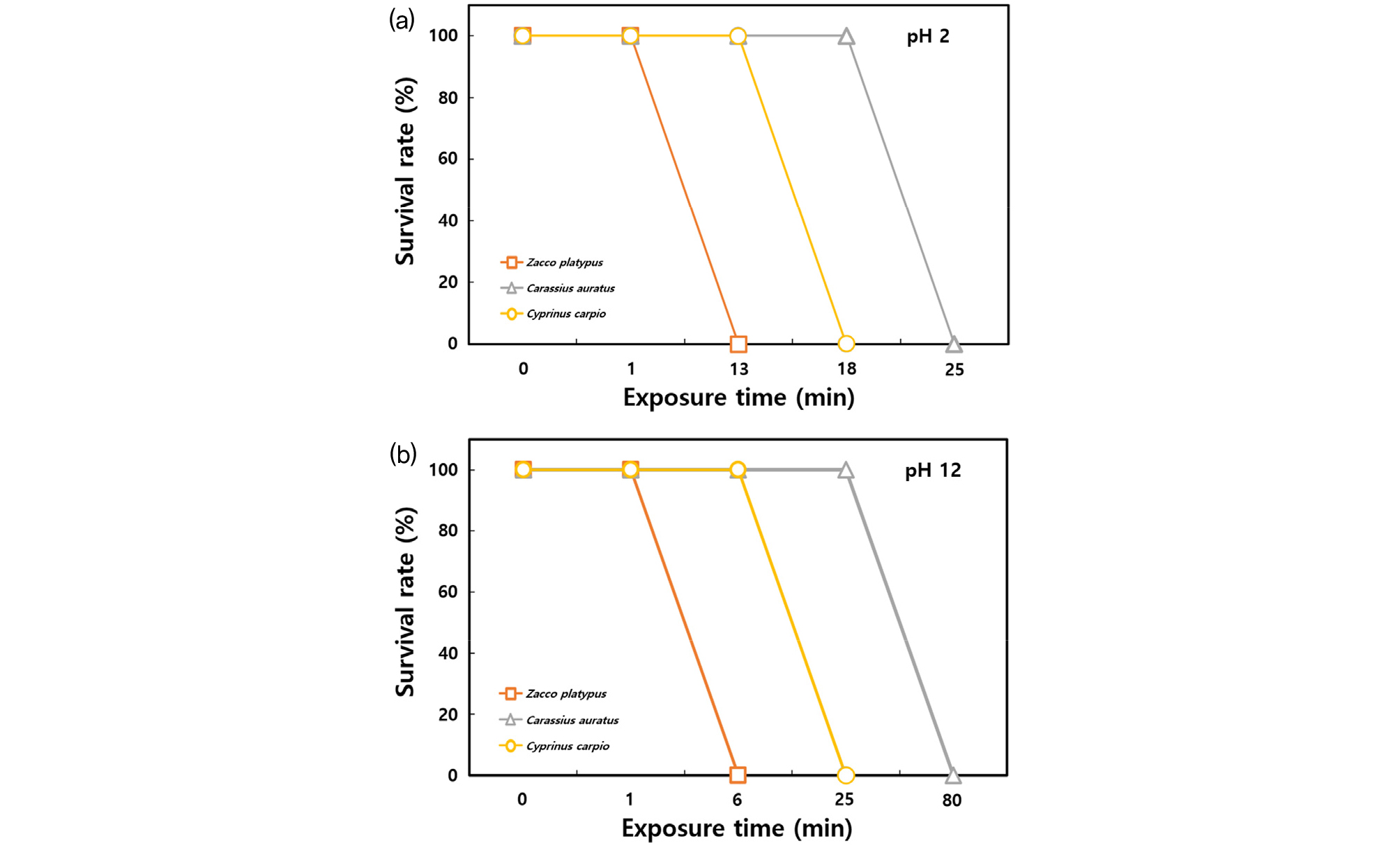
pH 감소에 따른 산성 조건에서 어류의 영향을 확인하기 위해 pH 2의 수조에 어류를 노출한 결과, 아가미 출혈, 지느러미 및 피부 부식, 발작 등이 관찰되었으며, 크기가 큰 개체들부터 증상을 보였다. pH 감소에 따른 민감도는 피라미>잉어>붕어 순서로 민감하게 반응하였다(Fig. 3(a)). 피라미는 노출 직후 발작(1초 이내), 유영능력 및 균형감각 상실 증상이 관찰되었고, 1분 경과 후 아가미 출혈이 발생하였으며, 13분 경과 후 모든 개체가 사망하였다. 붕어의 경우, 노출 직후 발작 및 유영능력 감소 증상이 관찰되었고, 1분 40초에 아가미 출혈, 13분에 균형감각 상실이 관찰되었으며, 25분 경과 후 모든 개체가 사망하였다. 잉어는 노출 직후 발작 및 유영능력 감소 증상이 관찰되었고, 1분 40초에 아가미 출혈, 3분 40초에 균형감각 상실이 관찰되었으며, 18분 경과 후 모든 개체가 사망하였다(Fig. 3(a)). 해부를 통한 외형 및 내장 기관 관찰 결과, 내장 기관의 손상은 관찰되지 않은 반면 아가미 새엽부가 부식되어 출혈이 발생하였고, 대부분의 지느러미 및 피부에서 부식이 관찰되었다.
pH 증가에 따른 염기성 조건에서 어류의 영향을 확인하기 위해 pH 10 및 12의 수조에 어류를 노출한 결과, pH 10 조건에서는 사망 개체 및 이상 증상이 관찰되지 않았고, pH 12 조건에서 점액질 분비, 출혈 및 혈액 응고, 과호흡, 발작, 피부 부식 등이 관찰되었으며, 민감도는 피라미>잉어>붕어 순서로 반응하였다(Fig. 3(b)). 피라미는 투입 즉시 발작 증상을 보였으며, 20초 경과 후 점액질 과다 분비, 3분 50초부터 균형감각 상실, 6분 경과 후에 모든 개체가 사망하는 증상을 보였다. 붕어의 경우, 투입 즉시 발작 증상을 보였고, 20초에 점액질 과다 분비, 3분 30초 경과 후부터 균형감각 상실이 관찰되었으며, 1시간 20분 경과 후 모든 개체가 사망하였다. 잉어는 투입 즉시 발작 증상을 보였고, 10초 경과 후부터 점액질 과다 분비, 3분 30초 경과 후부터 균형감각 상실이 관찰되었으며, 25분 경과 후에 모든 개체가 사망하였다(Fig. 3(b)). 해부를 통한 외형 및 내장 기관 관찰 결과, 내장 기관의 손상은 관찰되지 않았고, 아가미 및 피부가 부식되어 출혈이 발생하였고, 혈액이 점액질과 섞여 아가미 및 피부 등에 응고된 것이 관찰되었다.
우리나라 대부분의 수계는 pH 6~8 내외의 환경 조건을 보이고 있으며, 담수 어류는 이러한 환경에 적응하여 서식하고 있는 것으로 알려져 있다(물환경정보시스템 수질측정망 및 생물측정망; water.nier.go.kr). 수생태계의 pH 변화는 대표적으로 녹조류의 광합성에 의한 변화, 산, 염기 등 화학물질의 노출 사고 등에 의해 발생한다. 정상 범위의 pH를 벗어난 산성과 염기성의 수환경은 어류에게 혈성분, 단백질, 면역력, 항산화능, 이온교환능 등을 감소시켜 생리학적 피해를 입히며(Kristinsson & Hultin, 2004; Aride et al., 2007; Ghanbari et al., 2012; Kim et al., 2021), 내성 범위를 초과할 경우, 영구적인 손상이나 폐사에 이르게 된다(Alabaster & Lloyd, 2013). 낮은 pH 조건에서는 철 및 알루미늄 등 중금속 이온 활성화도가 높아져 치명적인 독성을 유발하며, 아가미를 비롯한 세포 내 tight junction을 파괴하여 Na+, Cl-, Ca2+ 등의 이온 교환 방해(Kwong & Perry, 2013), cortisol 분비 자극 등 악영향을 일으킨다(Chasiotis et al., 2010; Kelly & Chasiotis, 2011). 본 연구의 고산성(pHL) 실험에서 공통 증상으로 출혈 및 아가미 손상이 관찰되었는데, 이는 위에서 언급한 세포 내 밀착연접의 파괴로 인한 증상으로 판단된다. 반면, pH 9 이상의 알칼리 조건에서는 아가미 상피세포 괴사 및 점액세포 비대, 삼투 조절 장애 등을 일으켜 심각한 호흡 곤란을 유발하며, pH 11 이상으로 높아지게 되면 급성 치사로 이어지게 된다고 보고되어 있다(Boyd, 1998; Shin, 2015). 붕어를 대상으로 시멘트 분말의 영향을 실험한 연구에 의하면, 높은 pH와 유해성분에 의해 아가미 새변 손상, 염세포와 점액세포 활성 증가 등의 붕어 조직의 형태적 변형과 생리적 기능에 악영향을 미치는 것으로 나타났다(Shin, 2015). 본 연구에서도 점액질 분비 증가, 호흡 곤란 등 선행 연구와 유사한 결과가 관찰되었으며, 이러한 반응 특성들은 수계 내 pH 변화에 따른 어류폐사 발생 시 원인 규명을 위한 중요한 증거로 활용할 수 있을 것으로 사료되었다. RNA 분석 결과에서 세포 내 유전자 발현이 증가하였고, 단백질 결합 관련 유전자 및 성장 관련 유전자의 활성이 확인되어 세포 기작 및 호르몬 생성에 영향을 주고 있는 것으로 판단되었다.
3.4 고탁도
탁수 유입에 따른 어류의 영향을 확인하기 위해 1,000 NTU의 고탁도 조건에서 2주 동안 노출 실험을 실시한 결과, 모든 실험종에서 사망 개체는 관찰되지 않았다. 고탁도 노출 조건으로 인해 어류의 행동 특성은 관찰할 수 없었으나, 해부를 통한 외형 및 내장 기관 관찰 결과 표피 탈색, 아가미 및 지느러미 점토 침착, 아가미 점액질 분비 등이 관찰되었으며, 일부 개체에서는 지느러미 부식 증상도 관찰되었다.
최근 우리나라는 기후변화에 따른 집중 강우의 빈도가 높아지고 있으며, 집중강우는 고농도의 탁수를 발생시켜 댐호에 유입되어 서식 생물에 영향을 주고 있다. 우리나라 임하호에서는 2002~2003년 태풍의 영향으로 고농도의 탁수가(1,221 NTU) 유입되었고, 315일간 댐호에 영향을 미친 사례가 있다(이근상 & 조기성, 2004). 어류가 고농도의 탁수에 노출될 경우, 아가미 이차새변 변이 및 이물질 흡착, 점액세포 분비 활성화, 사구체 수축, 혈성분 이상 등의 장애를 일으키며(이청 등, 2006; 신명자 등, 2008), 발생 초기 단계 및 치어 생존에 특히 치명적인 것으로 알려져 있다(Moon et al., 2012). 본 연구의 노출 실험 결과에서도 탈색, 아가미 이물질 흡착, 점액질 분비, 세균 감염 등의 증상이 관찰되었으며, RNA 분석 결과에서 세포 내 유전자 발현, 단백질 결합 관련 유전자, 방어 기작 관련 유전자의 활성이 확인되어 탁수유입에 따른 어류 폐사 발생 시 원인 분석을 위한 중요한 반응 특성으로서 활용될 수 있을 것으로 판단되었다.
3.5 RNA sequencing을 통한 유전자 발현 분석
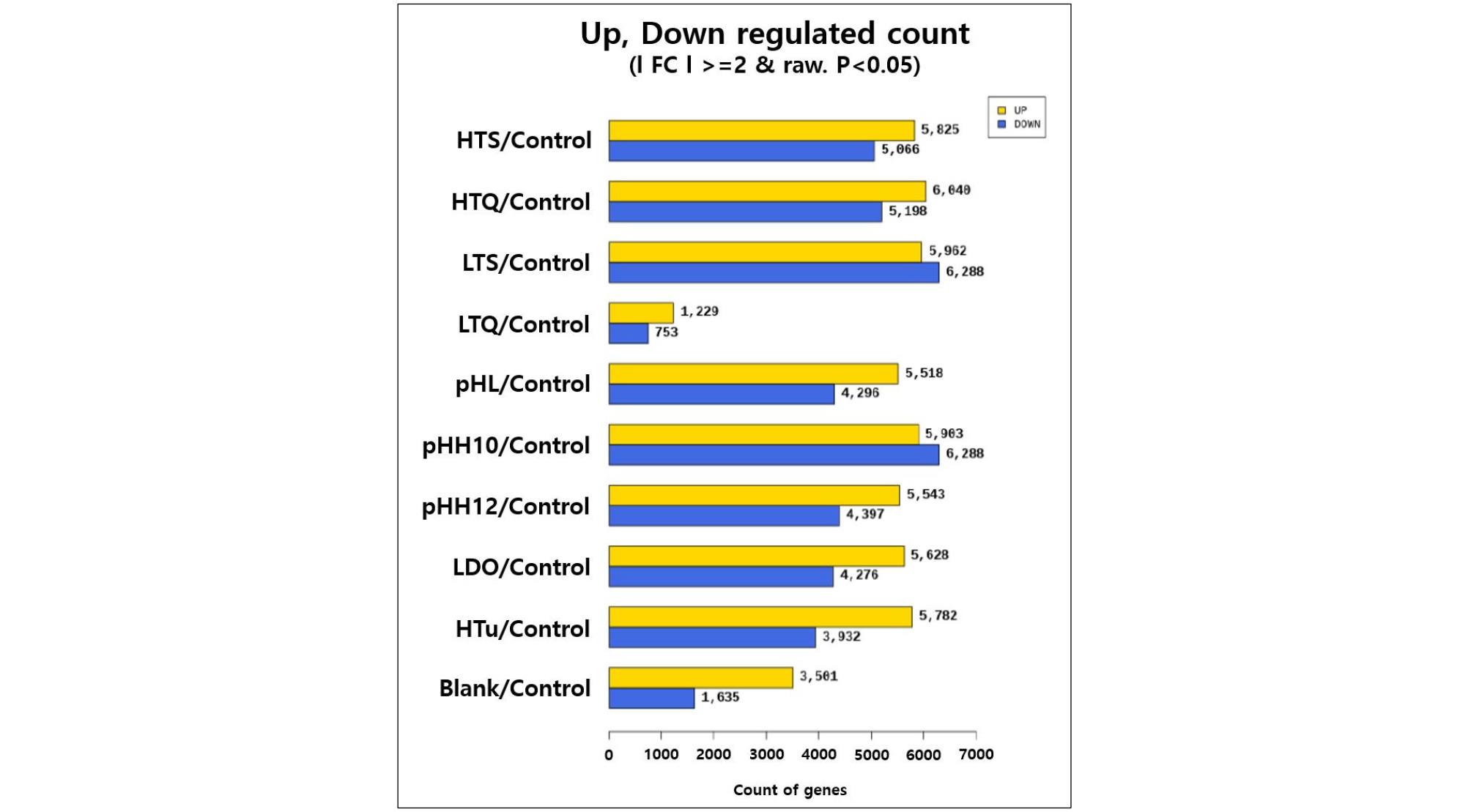
제브라피쉬를 대상으로 차세대 염기서열 분석(NGS; Next generation sequencing) 플랫폼을 이용하여 전사체 서열분석(Transcriptome sequencing)을 실시한 결과, 대조군(Control)과 9개의 노출 조건에서 확보한 샘플을 비교하여 총 17,340개의 유의미한 차이를 보이는 DEG(Differentially expressed genes)가 추출되었다(Fig. 4). GO(Gene ontology) 분석 결과, 각 조건 별 대조군에 비해 유의하게 증가하거나 감소하는 발현 특성을 보인 유전자 수는 DO 고갈 실험 조건(LDO)에서 9,904개, 고수온 저속 노출 실험(HTS)에서 10,891개, 고수온 급속 노출 실험(HTQ)에서 11,238개, 저수온 저속 노출 실험(LTS)에서 12,250개, 저수온 급속 노출 실험(LTQ)에서 1,982개, 산성 노출 실험(pHL)에서 9,814개, 염기성(pH 10) 노출 실험(pHH_10)에서 12,191개, 염기성(pH 12) 노출 실험(pHH_12)에서 9,940개, 고탁도 노출 실험(HTu)에서 9,714개로 분석되었다(Fig. 4).
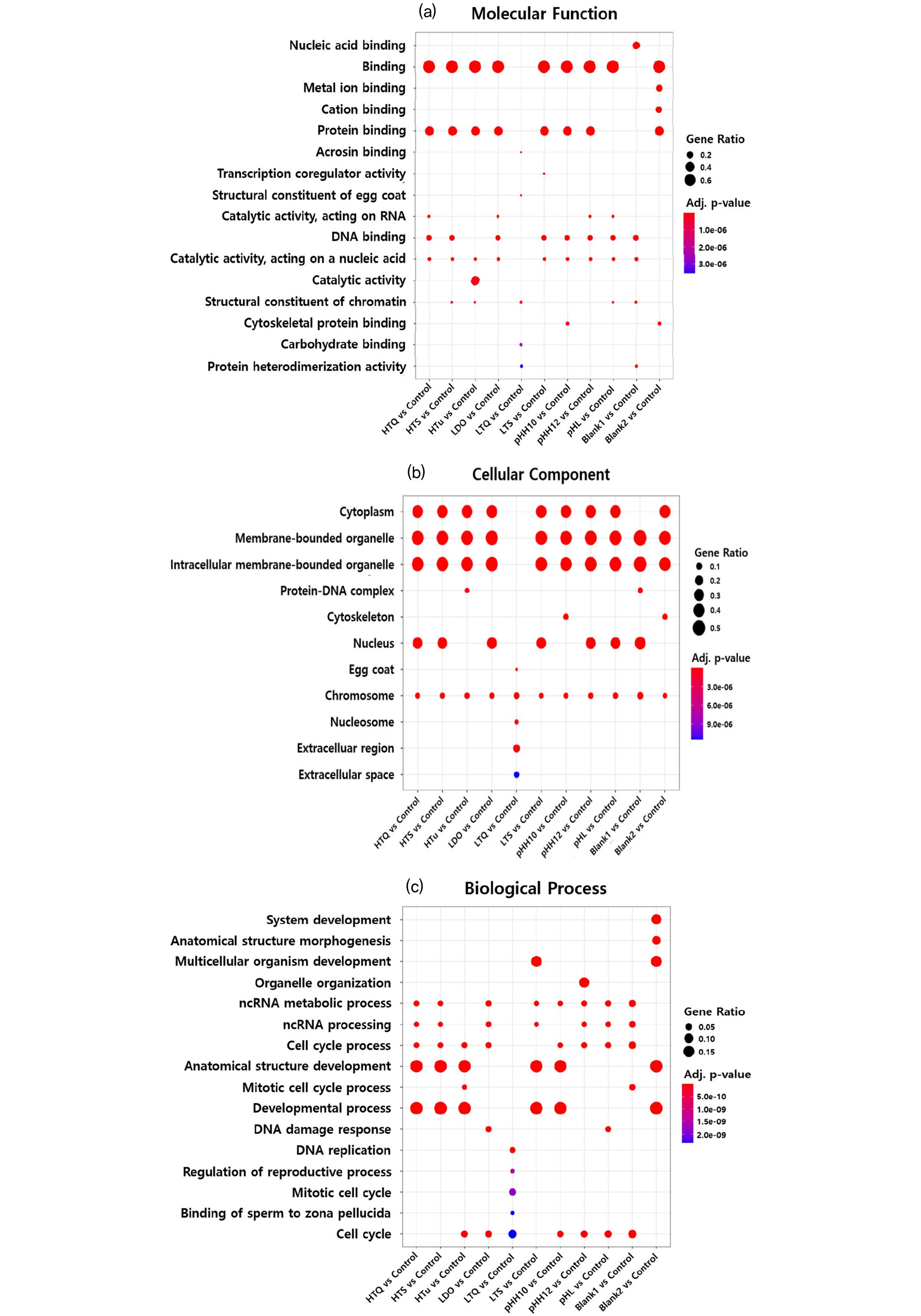
각 조건별 발현 유전자는 GO의 기능적 분류에 따라 분자 기능(Molecular function), 유전자의 세포 내외 위치(Cellular component), 생물학적 세포 기작(Biological process)로 분류되었다(Fig. 5). 분자 기능(Molecular function)은 생화학적 수준에서 유전자의 생산 산물인 단백질의 기능 또는 활성 가능성에 따라 분류되며, LTQ 조건을 제외한 모든 실험군에서 결합(Binding)과 관련된 유전자의 비율이 가장 높게 발현되었고, 단백질 결합(Protein binding)과 관련된 유전자 발현 비율이 높게 나타났다. 이는 각 물리적 스트레스 조건에 따라 체내 화학적 결합, 특히 단백질 결합(또는 반응)과 관련된 유전자가 활성화되었을 가능성이 크다는 것을 의미한다. HTu 조건에서는 유일하게 촉매 활성(Catalytic activity) 유전자 비율이 높게 나타났다. 이는 탁수에 노출된 어류에서 치사 개체가 발생하지 않고 가장 긴 시간 동안 노출되어 다양한 효소와 같은 촉매에 의한 화학반응이 활성화되었을 것으로 판단되었다(Fig. 5(a)).
세포 요소(Cellular component)는 유전자의 세포 내외의 위치에 따른 분류로서 LTQ 조건을 제외한 모든 실험군에서 세포 내 구성요소(세포막, 세포 소기관막, 세포질, 핵)에 위치한 유전자들이 발현된 것으로 확인되어 어류 폐사의 주요 물리적 스트레스 조건은 세포의 구성 요소들에 영향을 주고 있다고 판단되었다. 한편 LTQ 조건에서는 적은 비율의 유전자 발현이 확인되었으며, 발현된 유전자의 위치는 세포외에 위치한 유전자들로서 저수온에 노출된 개체는 노출 즉시 사망에 이르렀기 때문에 유전자 발현이 가장 적었을 것으로 판단되었다(Fig. 5(b)).
생물학적 세포기작(Biological process)은 생물학적 대사 과정에서의 역할에 따라 분류되며, 해당 유전자가 세포 내에서 일어나는 생물학적 과정에 관여할 가능성이 있음을 나타낸다. HTQ, HTS, LTS, HTu, pHH_10 조건에서 해부학적 구조 발달 등 성장과 관련된 유전자의 비율이 높게 발현되었다. LTS 및 pHH_12 조건에서는 각각 다세포 기관 발달 및 소기관 조직 관련 유전자 비율이 높게 발현되어 다른 노출 조건에서 발현되지 않은 특이적 발현 특성으로 판단되었으며, 이는 어류 폐사 원인 분석을 위한 유전자 지표로 활용 가능할 것으로 사료되었다. 한편, LTQ 조건에서는 분자 기능, 유전자의 세포 내외 위치 등의 GO 분류 기준과 같이 적은 비율의 유전자 발현 특성을 보였다(Fig. 5(c)).
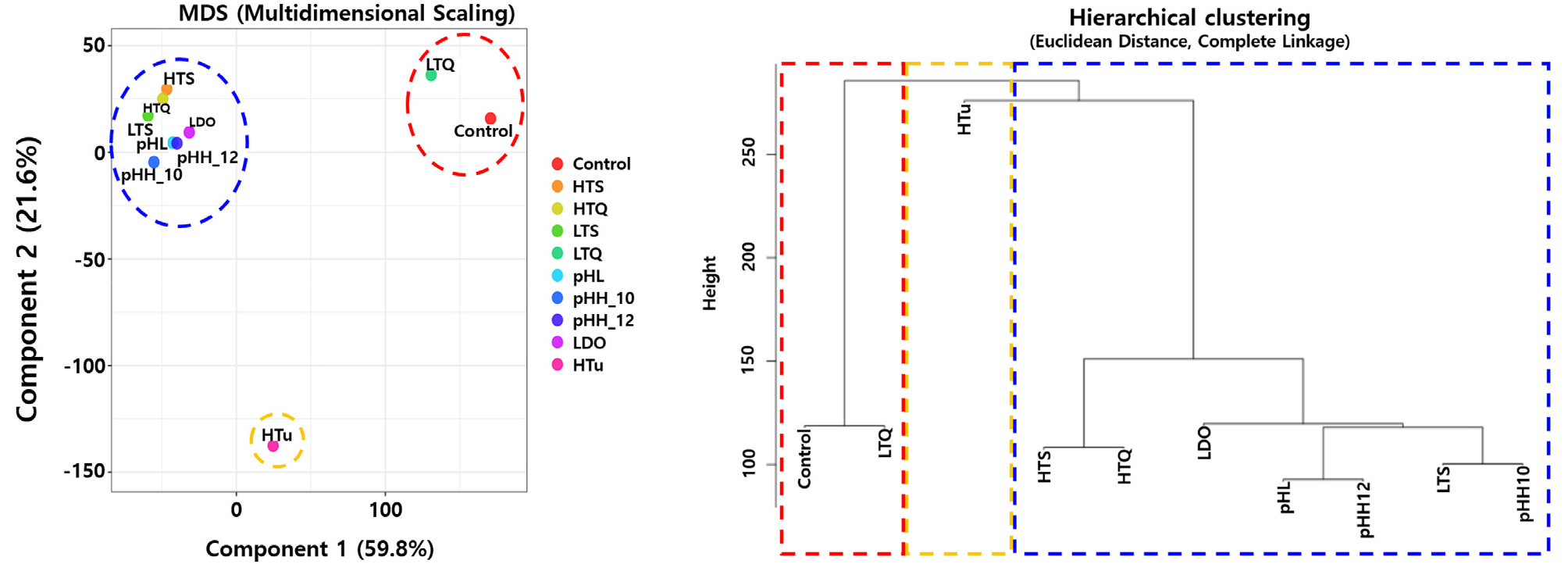
각 노출 조건에 따른 유전자 발현양상의 유사성을 확인하기 위해 계층군집 분석(Hierarchical clustering) 및 다차원 척도 분석(MSD; Multidimensional scaling)을 실시한 결과 유전자 발현 특성은 크게 3개의 그룹으로 분류되었다(Fig. 6). 첫 번째 그룹은 대조군과 LTQ 조건이었고, 두 번째는 HTu 조건, 마지막은 나머지 LDO, HTS, HTQ, LTS, pHL, pHH_10, pHH_12 노출 조건들이 유사한 유전자 발현 특성을 보이는 그룹으로 분류되었다. LTQ 조건의 어류는 유전자 발현이 나타나기 전에 급사하여 대조군과 유사한 발현 특성을 보이는 것으로 판단되었고, HTu 조건은 노출 어류가 사망하지 않고 장기간 생존하면서 사망 개체가 발생했던 노출 조건과 다른 방어기제를 보인 것으로 판단되었다. 그 외 노출 조건들은 비슷한 방어기제 방식을 보인 것으로 사료되었다.
4. 결 론
본 연구에서는 댐호에서 발생하는 어류 폐사의 효율적인 대응을 위한 기초자료를 확보하기 위해 K-water에서 관리하고 있는 댐/저수지를 대상으로 어류 폐사의 물리적 환경 요인 및 어종을 분석하여 노출 실험을 실시하고, 이때 발생하는 증상 및 유전자 발현 결과를 분석하여 어류 폐사 발생 시 원인 스크리닝에 활용할 수 있는 자료를 제공하고자 하였다. 어류는 용존산소 고갈, 수온 변화, pH 변화, 강우에 의한 탁수 유입 등의 다양한 환경변화를 겪고 있다. 대부분의 생물은 이러한 환경변화에 따른 스트레스에 적응하며, 스스로 대응할 수 있는 체내 시스템을 갖추고 있다. 그러나 스트레스 지속 기간 및 강도가 높아질 경우 성장 및 생식 저해, 질병 저항성 감소 등의 영향이 나타나게 되고 결국 폐사에 이르게 된다(신명자, 2011; Shin et al., 2018). 본 연구에서는 어류 폐사 사례를 바탕으로 주요 어종으로 선정된 피라미, 붕어, 잉어를 바탕으로 다양한 물리적 노출 조건에서 실험을 수행하였다. 실험을 통해 확인된 반응 특성들은 어류 폐사 발생 시 원인이 되는 환경 스트레스를 유추할 수 있는 정보를 제공하며, 현장에서 수집하는 다양한 증거를 뒷받침하는 자료로 활용할 수 있을 것으로 판단된다. 잉어와 붕어의 경우, 대부분의 노출 실험에서 증상 관찰 및 사망까지의 반응 시간이 가장 길었으며, 환경변화에 대한 내성이 높은 것으로 나타났다. 특히, 잉어의 경우, 산성 및 염기성 조건, DO 고갈, 고수온 등의 극한조건에서도 장시간 생존한 것으로 나타나 실제 수생태계 수환경 변화 시, 다른 어종들에 비해 장시간 생존 가능할 것으로 판단된다. 붕어 및 잉어는 댐호에서 발생하는 어류 폐사의 주요 종으로서 어류 폐사 발생 시 이들 종이 마지막까지 생존할 가능성이 크며, 원인 분석을 위한 다양한 생체 증거들이 체내에 남아 있을 가능성이 커 어류 폐사 지표종으로 활용할 수 있을 것으로 판단된다. 본 연구에서는 유전자 정보의 부족으로 피라미, 붕어, 잉어 대신 국제시험종인 제브라피쉬를 이용하여 RNA 분석을 실시하였으나 추후 붕어 및 잉어를 이용하여 유전자 분석을 수행하고 각 시험 조건에 따른 유전자 발현 특성을 분석한다면 현장에서 증거가 부족한 경우에도 유전자 분석을 통해 폐사 발생 원인을 추정하는데 중요한 정보를 제공할 수 있을 것으로 사료되었다.